| Nr. |
DIAGRAMM |
BESCHREIBUNG |
| A1 |
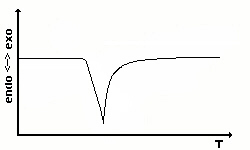 |
Die einfachste DTA-Kurve eines endothermen Prozesses ist die
einer
Phasenumwandlung erster Ordnung.
Jede Substanz, die einen solchen Kurvenverlauf hervorruft, ist als
Kalibriersubstanz verwendbar. |
| A2 |
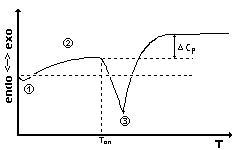 |
Eine theoretische Schmelzkurve zeigt den folgenden Verlauf:
Zu Beginn des Aufheizprogrammes ist eine Anfahrauslenkung zu
beobachten,
deren Form von der Menge der Referenzsubstanz abhängig ist(1). Im
weiteren Verlauf zeigt die Kurve die Änderung der
Wärmekapazität
der Probe(2). Während des Schmelzvorganges ist die Steigung der
Kurve
der Heizrate proportional. Am Punkt (3) ist die Substanz
vollständig
aufgeschmolzen, der weitere Verlauf zeigt die exponentielle Relaxation.
Wenn sich die Wärmekapazität Cp während der
Phasenumwandlung
geändert hat, ist die Basislinie in der Höhe verschoben.
Die Schmelztemperatur wird als Tonset extrapoliert. |
| A3 |
 |
Diese Probe war zu grobkörnig. Um ein scharfes Signal zu
erhalten
muss die Substanz fein verrieben werden.
Manchmal wird ein ähnlicher Effekt beobachtet, wenn sich beim
Schmelzvorgang kleine Gasblasen bilden. |
| A4 |
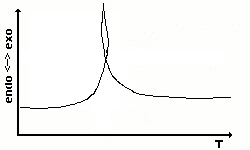 |
Eine solche eingewickelte Kurve (Envelope) erhält man
häufig,
wenn heftige chemischen Reaktionen beobachtet werden. In solchen
Fällen
kann man anstelle der Temperatur die Zeitskala als X-Achse wählen.
Den Temperaturprogrammverlauf stellt man dann als eine weitere Linie im
Diagramm dar. |
| A5 |
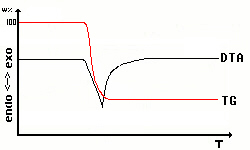 |
Bei der Beobachtung chemischer Reaktionen mit der Gasphase
wie bei
Zersetzungen oder Synthesen ist es immer interessant, gleichzeitig mit
dem DTA-Signal das Thermogravimetriesignal aufzunehmen. Dies ist eine
gute
Methode, mehr über die chemische Reaktionen zu erfahren und sie
eindeutig
von Phasenumwandlungen zu unterscheiden.
Die Y-Achse hat nun gleichzeitig 2 unterschiedliche Skalen:
Differenztemperatur
und Gewichtsprozent. |
|
Und nun: |
Einige reale Diagramme |
| 1 |
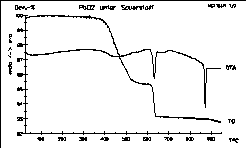 |
Dieses Diagramm zeigt die thermische Zersetzung von PbO2
in reiner Sauerstoffatmosphäre.
Eine Probe von 53 mg wurde mit 4K/min aufgeheizt. Die Bildung von
Mennige
setzt bei 400°C ein. Diese zersetzt sich erst oberhalb von
620°C
unter den Reaktionsbedingungen! Beachten Sie den scharfen Schmelzpeak
von
PbO.
Erste Stufe: 3 PbO2 -> Pb3O4
+ O2
Zweite Stufe: Pb3O4 -> 3 PbO + 1/2 O2
|
| 2 |
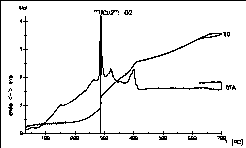 |
Das Oxidationsverhalten einer intermetallischen Legierung der
formalen
Zusammensetzung "TlCu2" unter reinem Sauerstoff wurde mit
dem
Ziel untersucht, die optimalen Synthesebedingungen für das
Thalliumkupfercuprat
TlCu(CuO2) aufzufinden. Nach der Auswertung der Daten
konnten
etliche Kristalle der Zielverbindung gezüchtet werden! Diese
Modelsubstanz
wurde 1991 entdeckt von Arnold
Adam, Claudia Felser-Wenz, H.-U. Schuster und R. Hoppe.
Ref.:
Z. Anorg. allg. Chem. 605 (1991) 157-62. |
| 3 |
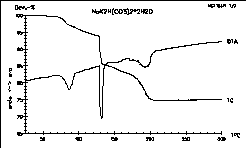 |
Die Thermolyse von NaK2H(CO3)2 *
2
H2O unter Argon ist ein schönes Beispiel für eine
dreistufige Zersetzung.
Dieses Hydrogencarbonat wurde im Arbeitskreis
Adam von Vytas Cirpus synthetisiert und untersucht.
Ref.: A. Adam, V. Cirpus
"Die ersten gemischten Alkalimetallhydrogencarbonate NaA2[H(CO3)2]
*
2 H2O mit A = K, Rb" 25. GDCh-Hauptversammlung,
Münster,
Coll. Abstr. (1995) 483.
|
| 4 |
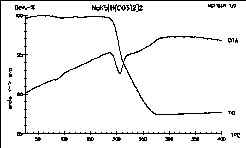 |
NaK5[H(CO3)2]2
wurde
ebenfalls unter Argon gemessen: auf den ersten Blick scheint sich die
Substanz
in einem Schritt zu zersetzen. Bei genauerer Betrachtung der TG-Linie
findet
man jedoch ein Knick in der Steigung, welcher eindeutig zeigt,
daß
hier zwei Schritte überlappen. Auch diese Substanz stammt von
Vytas!
Ref.: V. Cirpus, A.
Adam
"NaK5[H(CO3)2] - das erste wasserfreie
Hydrogenbicarbonat"
Z. Kristallogr., Suppl. Issue 15 (1998) 28.
|
| 5 |
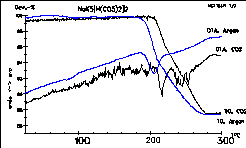 |
Das Diagramm zeigt die gleiche Substanz wie in Nr. 4. Die
schwarz gezeichnete
Messung wurde unter CO2-Atmosphäre durchgeführt,
was
zu einer Zersetzung bei höherer Temperatur führt. Bei
Messungen
unter Kohlendioxid beobachtet man häufig verrauscht aussehende
Signale,
was auf Interaktionen zwischen dem Gas und der Probenoberfläche
zurückzuführen
ist. |
| 6 |
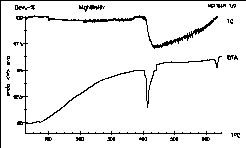 |
MgNiInHx - wieviel Wasserstoff konnte Axel Karge
aus der
Arbeitsgruppe Schuster in seiner Verbindung speichern? Es waren beinahe
drei Gewichtsprozent!
Die Argonatmosphäre war leider nicht ganz sauerstofffrei, wie
die TG-Kurve zeigt.
Axel Karge, Dissertation Köln 1997.
|
| 7 |
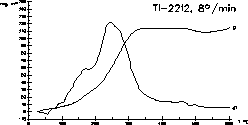 |
Die Synthese des Hochtemepartursupraleiters Tl-2212 gelingt
durch langsame
Oxidation einer abgeschreckten Legierung der metallischen Komponenten
mit
reinem Sauerstoff. Die Oxidation einer gut präparierten Legierung
verläuft in einem Schritt unter Kontrolle der thermischen
Parameter.
Ref.: H.-U. Schuster, J. Wittrock: J. Thermal. Anal. 39
(1993) 1397-1401.
|
| 8 |
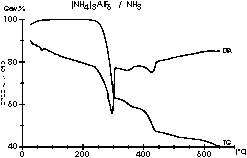 |
Eine DTA/TG-Messung unter Ammoniak:
Meike Roos untersuchte die Wege der Ammonolysereaktionen von
Ammoniumhexafluorometallaten
des Typs (NH4)3MF6 (M = Al, Ga, In)
mit
Hilfe der In-situ-Pulverdiffraktometrie und DTA-Methoden. Nach dem
Auffinden
der optimalen Messparameter erhielten wir diese aussagekräftigen
Diagramme,
welche hervorragend mit den Ergebnissen anderer analytischer Methoden
korrelieren.
In diesem Diagramm wird die Aluminiumverbindung gezeigt. |
| 9 |
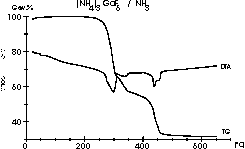 |
Ein komplexes Schema für die Reaktionen zwischen (NH4)3GaF6
und NH3, welches über viele Zwischenstufen
verläuft
und zu GaN führt, ist in der nachfolgenden Literaturstelle
beschrieben:
Meike Roos, Jörg Wittrock, Gerd
Meyer, Silvia Fritz and Joachim Strähle:
Z. Anorg. Allg. Chem. 626 (2000) 1179-1185. (Diagram 8, 9
and
10)
Dabei sieht das Diagramm der Messung unter Ammoniak bei 1 Atm
so einfach
aus ...
|
| 10 |
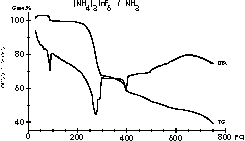 |
Einen ganzen Korb voller Fragen und Ergebnisse lieferte die
Untersuchung
der Ammonolyse von (NH4)3InF6. Die
Reaktionswege
sind komplex und voller Überraschungen, wie Meike Roos und Gerd
Meyer
zeigen:
Z. Anorg. Allg. Chem. 625 (1999) 1839.
|
| 11 |
 |
Die Thermische Analyse in der Nähe des Schmelzpunktes
von Eis
ist immer eine Herrausforderung. Unsere neue Apparatur -
jetzt beim
FTA erhältlich - vereinfacht die Aufnahme
von Phasendiagrammen erheblich. Der Prototyp wurde in der Arbeitsgruppe
von Prof. Dr. Arnold Adam
(TU Clausthal) an der Universität zu Köln entwickelt.
Das Diagramm zeigt das System K2CO3 / H2O
in
der Nähe des kryohydratischen Punktes. Beachten Sie, daß
die Kurven so gezeigt werden, wie gemessen. Die Basislinien müssen
weder angepasst noch angeglichen werden!
|
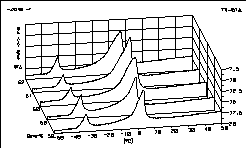
| 12 |
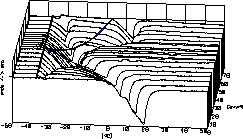 |
Unser Titelbild zeigt die DTA-Kurven des Systems K2CO3
/ H2O im Bereich von 0-75 Gewichtsprozent Kaliumcarbonat.
Die
zweiphasigen Gebiete erscheinen als Hochebenen zwischen den Tälern
der Phasenübergänge.
Diese zeichnen das Phasendiagramm als topografische Landkarte.
Die Literaturstelle ist vollständig auf unserer Phasenanalyse-Seite
wiedergegeben.
|
| 13 |
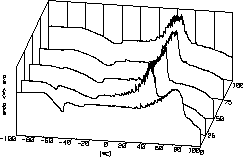 |
Arnold Adam
und sein
Arbeitskreis
untersuchen u.a. die Chemie von Carbonaten und Hydrogencarbonaten
der Alkali- und Eralkalimetalle, sowie in neuerer Zeit auch
peroxidhaltige
Verbindungen.
Die vorderste Kurve des Diagramms zeigt die Zersetzung von Perhydrol,
bei den folgenden wurde KHCO3 zugesetzt, was zu niedrigeren
Zersetzungstemperaturen führte. Das ausgeprägte Zackenmuster
der Zersetzungspeaks ist auf Blasenbildung zurückzuführen:
jedes
Bläschen macht sein eigenes kleines Signal. |
| 14 |
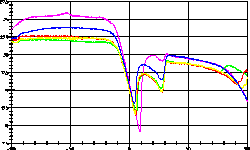 |
Wegscheiderit Na2CO3 * 3 NaHCO3
-
war das Thema dieser Messreihe. Das System Na2CO3
/ NaHCO3 / H2O ist sehr komplex und
schließt
auch Trona Na2CO3 * NaHCO3
* 2 H2O ein. Beachten Sie die Verschiebung der Basislinien,
welche aus den unterschiedlichen Wärmekapazitäten der
gleichgewichtigen
Proben resultiert. |
| 15 |
 |
Auf den Kopf gestellt! Dies ist ein Ausschnitt aus dem K2CO3
/ H2O-Diagramm. Manchmal kann man den Beginn eines Signals
aus
dieser Perspektive besser erkennen. Der Mensch bemerkt eine leichte
Steigung
viel deutlicher als ein sanftes Gefälle... |
| 16 |
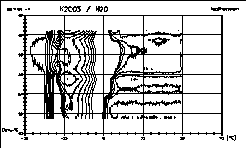 |
Hier sind Iso(differenz)temperaturlinien des Diagramms Nr. 12
dargestellt.
Sie zeichnen ein interessantes Bild des gut bekannten Phasendiagramms.
Die bei einigen Kurven auftretenden Anomalien könnten als
Artefakte
interpretiert werden. Wenn aber gut hundert Kurven ein solch
kohärentes
Bild ergeben, ist es schon einen genaueren Blick wert. Wir werden Sie
auf
dem Laufenden halten. |
|
wird fortgesetzt... |
Ein herzliches Dankeschön an alle Kollegen für die
gute Zeit
in Köln! |


















